Dr. Rafael Amaral de Castro, CRM-DF 13827
CLÍNICA MÉDICA - RQE Nº: 9934
ONCOLOGIA CLÍNICA - RQE Nº: 10032
A Revolução dos Anticorpos Droga-Conjugados no Tratamento do Câncer
🎯 Descubra como os ADCs estão revolucionando o tratamento oncológico! Neste texto com vídeo, o Dr. Rafael Amaral de Castro, oncologista de Brasília, explica de forma didática como funcionam os Anticorpos Droga-Conjugados (ADCs) - uma das mais promissoras inovações no combate ao câncer. Projeto Neoaccess - Democratizando o acesso ao conhecimento oncológico de qualidade.
Dr Rafael Amaral de Castro
9/19/20259 min read
Assista o vídeo aqui
Assista vídeo avançado 1 aqui
Assista o vídeo avançado 2 aqui
Anticorpos Conjugados a Drogas (ADCs) no Tratamento Oncológico: Precisão e Potência em Tumores Sólidos
Introdução aos Anticorpos Droga-Conjugados
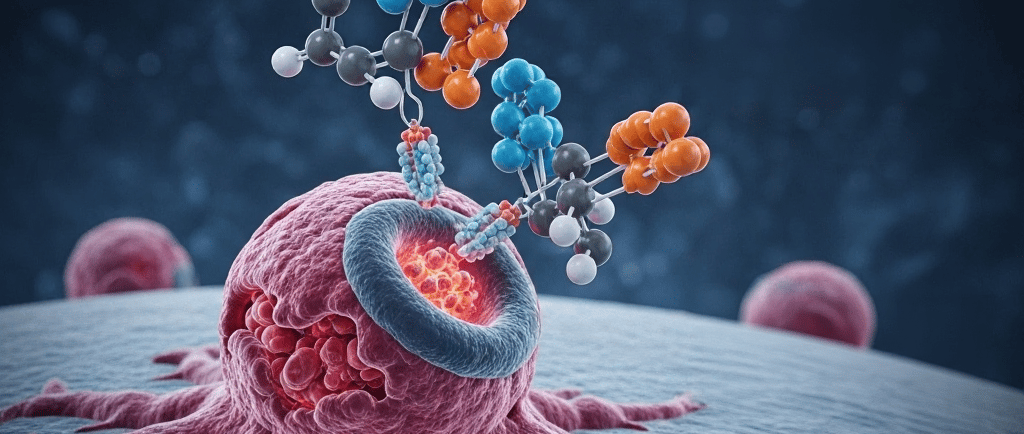
No contexto da oncologia moderna, os anticorpos droga-conjugados (ADCs) emergem como uma das inovações mais significativas e promissoras no combate ao câncer. Em uma palestra didática, Dr. Rafael Amaral de Castro, renomado oncologista de Brasília, apresenta uma visão clara sobre como essa tecnologia revolucionária opera. Os ADCs são frequentemente chamados de "mísseis teleguiados" no tratamento, devido à sua habilidade de direcionar medicamentos diretamente às células cancerosas, minimizando os efeitos colaterais e maximizando a eficácia.
Como Funcionam os Anticorpos Droga-Conjugados
Os ADCs funcionam através de uma combinação estratégica de precisão e potência. Cada ADC é formado por um anticorpo que reconhece uma proteína específica na superfície das células tumorais, ligando-se a elas. Uma vez que o anticorpo esteja ligado à célula cancerosa, o medicamento quimioterápico é liberado diretamente dentro da célula, eliminando-a a partir de dentro. Este método não só aumenta a eficácia no trato oncológico, mas também pode reduzir significativamente os efeitos adversos que muitas vezes acompanham as terapias convencionais.
O Conceito Revolucionário dos ADCs
Os Anticorpos Conjugados a Drogas (ADCs) representam uma das mais significativas inovações na oncologia moderna. Essencialmente, um ADC é uma plataforma terapêutica que combina a alta especificidade de um anticorpo monoclonal com a potente citotoxicidade de um agente quimioterápico. Essa engenharia molecular permite uma entrega seletiva do fármaco diretamente às células tumorais, poupando os tecidos saudáveis adjacentes.
Cada ADC é composto por três elementos cruciais que trabalham em sinergia:
1. Anticorpo Monoclonal: A "chave" que reconhece e se liga a um antígeno específico superexpresso na superfície das células cancerígenas. Este componente garante a seletividade e o direcionamento ao tumor.
2. Agente Citotóxico (Payload): A "carga" altamente potente, frequentemente um quimioterápico, capaz de induzir a morte celular programada (apoptose) ou necrose. A concentração desse agente é liberada de forma localizada, maximizando o efeito antitumoral.
3. Ligante (Linker): A "ponte" molecular que conecta o anticorpo ao agente citotóxico. O design do ligante é crítico, pois deve ser estável na circulação sistêmica para evitar a liberação prematura do fármaco, mas facilmente clivado e ativado uma vez dentro da célula tumoral, permitindo a liberação eficiente do payload.
O Princípio de Funcionamento: Uma "Bala Mágica" Realizada
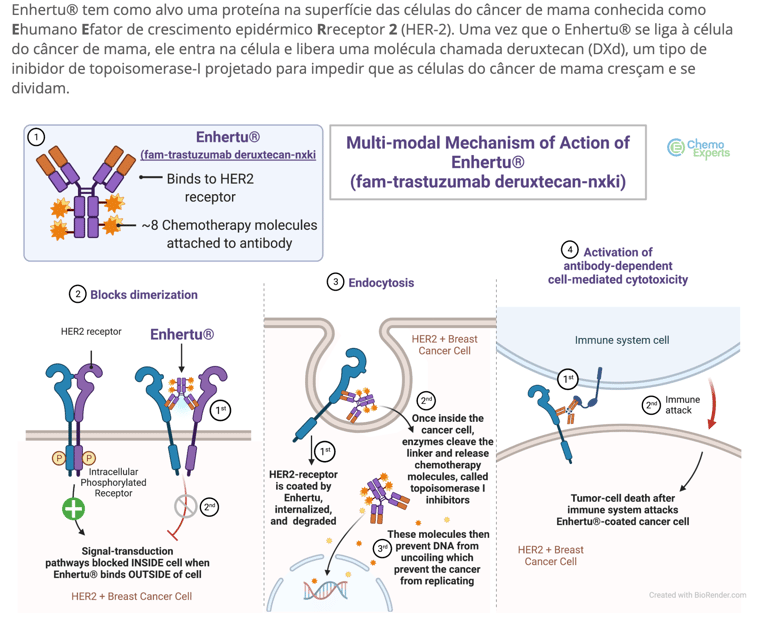
O mecanismo de ação dos ADCs é elegante e altamente eficiente. Uma vez administrado, o ADC circula no organismo até encontrar células que expressam o antígeno-alvo em sua superfície. O anticorpo se liga a esse antígeno, e o complexo anticorpo-droga-ligante é internalizado pela célula tumoral via endocitose.
No ambiente intracelular, geralmente em compartimentos lisossomais ou endossomais, o ligante é clivado por enzimas específicas (proteases) ou por condições de pH ácido, liberando o agente citotóxico em sua forma ativa. Esta liberação intracelular do quimioterápico em altas concentrações é o que confere a potência terapêutica dos ADCs, levando à morte da célula cancerígena. Além disso, muitos ADCs exibem um "efeito bystander", onde o agente citotóxico liberado pode difundir-se para células tumorais vizinhas que não expressam o antígeno-alvo de forma tão robusta, ampliando o efeito antitumoral. Este efeito é particularmente relevante em tumores heterogêneos.
Breve Retrospectiva Histórica
A ideia de um tratamento direcionado para o câncer remonta ao início do século XX com a visão de Paul Ehrlich da "bala mágica". Contudo, a tecnologia para transformar essa visão em realidade terapêutica só começou a amadurecer nas últimas duas a três décadas. Os primeiros ADCs aprovados, no início dos anos 2000, focaram principalmente em neoplasias hematológicas.
No entanto, foi nos últimos 10 a 15 anos que os avanços em engenharia de anticorpos, desenvolvimento de ligantes mais estáveis e a identificação de agentes citotóxicos mais potentes impulsionaram os ADCs para o centro da oncologia de precisão, especialmente em tumores sólidos. Essa evolução contínua tem posicionado os ADCs como uma fronteira promissora no arsenal terapêutico moderno.
ADCs na Oncologia de Tumores Sólidos: Um Panorama Abrangente
Embora a aplicação mais conhecida dos ADCs esteja no câncer de mama, a pesquisa e o desenvolvimento têm expandido seu uso para uma vasta gama de tumores sólidos, transformando as opções de tratamento para pacientes que antes tinham prognósticos limitados.
Câncer de Mama: Uma Aplicação Pioneira e em Expansão
No câncer de mama, a classificação do status HER2 é um pilar fundamental para guiar o tratamento, e os ADCs trouxeram novas nuances a essa estratificação.
● HER2 Positivo: Caracterizado pela superexpressão do receptor HER2, detectada por imunohistoquímica (IHQ) 3+ ou IHQ 2+ com amplificação confirmada por FISH/CISH. Esta categoria representa aproximadamente 15-20% dos casos de câncer de mama, historicamente associada a uma doença mais agressiva, mas altamente sensível a terapias anti-HER2 direcionadas.
● HER2 Low: Uma categoria mais recentemente definida, abrangendo tumores com expressão fraca a moderada de HER2 (IHQ 1+ ou IHQ 2+ com FISH negativo). A identificação desta categoria ampliou significativamente o número de pacientes que podem se beneficiar de ADCs com efeito bystander, impactando células vizinhas mesmo com menor expressão do alvo.
● HER2 Ultra Low: Representa o nível mais baixo de expressão de HER2 (IHQ 0, mas com um padrão de membrana positiva muito fraca). Embora ainda em estudo, alguns ADCs já demonstram atividade mesmo nesta população, sugerindo uma expansão ainda maior das indicações.
Principais ADCs no Câncer de Mama e Cenários de Uso:
Diversos ADCs têm sido aprovados ou estão em estágio avançado de pesquisa para o câncer de mama, cobrindo múltiplos subtipos e cenários clínicos:
● Ado-Trastuzumabe Emtansina (T-DM1 ou Kadcyla): Este ADC tem como alvo o HER2 e é uma pedra angular no tratamento do câncer de mama HER2-positivo. É indicado em adjuvância para pacientes com doença residual após tratamento neoadjuvante e cirurgia. No cenário paliativo, é amplamente utilizado como segunda linha para doença metastática HER2-positiva. No que tange ao câncer de mama triplo-negativo e HER2-low/ultra-low, seu uso não é habitual nem usual, respectivamente, dado seu mecanismo de ação específico para HER2.
● Trastuzumabe Deruxtecana (T-DXd ou Enhertu): Também direcionado ao HER2, o T-DXd demonstrou eficácia notável, sendo aprovado para câncer de mama HER2-positivo e HER2-low em doença metastática paliativa. Sua indicação se estende a ser um tratamento padrão para recidiva precoce pós-adjuvância em HER2-positivo. Além disso, está ativamente sendo investigado em estudos de neoadjuvância. Seu uso em triplo-negativo não é usual.
● Sacituzumabe Govitecana (SG ou Trodelvy): Este ADC inovador atua contra o antígeno Trop-2, amplamente expresso em muitos tumores sólidos. É um tratamento essencial para câncer de mama triplo-negativo metastático no cenário paliativo, após falha de quimioterapia ou imunoterapia prévias. Adicionalmente, mostra atividade em tumores RH-positivo e HER2-negativo extensivamente pré-tratados na doença metastática. Sua eficácia se estende a pacientes com metástases.
● Datopotamabe Deruxtecana (Dato-DXd): Outro ADC que tem como alvo o Trop-2, o Dato-DXd está sendo avaliado para câncer de mama RH-positivo/HER2-negativo em tratamento paliativo metastático, especialmente após terapia endócrina e quimioterapia prévias. Atualmente, seu uso no triplo-negativo ainda está em fase de dados iniciais.
Outros Tumores Sólidos: Ampliando o Horizonte
A aplicação dos ADCs transcende o câncer de mama, com diversas aprovações e pesquisas em andamento para outras neoplasias:
● Câncer de Pulmão: ADCs direcionados a HER2, como o trastuzumabe deruxtecana, estão sendo investigados para câncer de pulmão com expressão de HER2 em cenários paliativos. O sacituzumabe govitecana (Trop-2) também é estudado em câncer de pulmão de células não pequenas (NSCLC) com expressão de Trop-2 para doença avançada. O foco principal ainda é o uso paliativo/metastático em estudos.
● Câncer Urotelial (Bexiga): Neste tipo de câncer, o Enfortumabe Vedotina (Nectin-4) é um ADC aprovado para câncer urotelial metastático, especialmente após falha em imunoterapia e quimioterapia. O sacituzumabe govitecana também está em uso e estudos para a doença avançada neste tumor, com o uso principal na doença metastática paliativa.
● Câncer de Ovário: O Mirvetuximabe Soravtansina (receptor folato α) é um ADC aprovado para câncer de ovário em tratamento paliativo de doença metastática e recidivante. Estudos em neoadjuvância e adjuvância ainda estão em fase inicial, indicando um potencial de expansão.
● Câncer de Colo de Útero (Cervical): ADCs são objeto de pesquisas para o câncer cervical avançado, com um foco particular em alvos como Trop-2. O uso ainda está em fase experimental e é predominantemente paliativo.
Considerações sobre os Cenários de Uso Clínico
A indicação dos ADCs varia consideravelmente entre os cenários clínicos, adaptando-se à história natural da doença e às necessidades do paciente:
● Adjuvância: Alguns ADCs, como o ado-trastuzumabe emtansina, são utilizados após a cirurgia e a quimioterapia neoadjuvante para reduzir o risco de recidiva, especialmente em pacientes com câncer de mama HER2-positivo com doença residual.
● Neoadjuvância: ADCs mais modernos, a exemplo do trastuzumabe deruxtecana, estão sendo ativamente estudados para reduzir o tamanho dos tumores antes da cirurgia, buscando otimizar os resultados cirúrgicos e patológicos. Atualmente, seu uso neste cenário é mais frequente em estudos clínicos.
● Doença Paliativa/Metastática: Esta é a principal área de aprovação para a maioria dos ADCs. Eles desempenham um papel crucial no tratamento de cânceres avançados ou metastáticos, oferecendo uma opção terapêutica vital para melhorar a sobrevida e a qualidade de vida em casos onde os tratamentos convencionais demonstraram falha ou esgotamento de opções.
Gestão dos Efeitos Colaterais: Um Equilíbrio Necessário
Apesar da maior especificidade em comparação com a quimioterapia tradicional, os ADCs não são isentos de efeitos adversos. Estes são geralmente atribuídos à toxicidade do agente citotóxico transportado, mesmo que de forma mais localizada. A monitorização cuidadosa é fundamental para a segurança do paciente e o manejo eficaz dessas toxicidades:
● Alterações Hematológicas: Incluem trombocitopenia (redução das plaquetas), neutropenia (redução dos neutrófilos, aumentando o risco de infecções) e, ocasionalmente, anemia.
● Neuropatia Periférica: Manifesta-se como formigamento, dor ou dormência nas extremidades.
● Toxicidade Hepática: Pode ser evidenciada por elevação das enzimas hepáticas.
● Doença Pulmonar Intersticial (DPI) ou Pneumonite: Uma inflamação pulmonar que exige atenção imediata e, por vezes, interrupção do tratamento.
● Distúrbios Gastrointestinais: Náuseas, vômitos, diarreia e constipação são efeitos comuns.
● Fadiga: Um efeito adverso frequente que impacta a qualidade de vida.
● Alopecia: Queda de cabelo, embora com incidência e gravidade variáveis dependendo do ADC.
Novidades e Perspectivas Futuras: A Evolução Contínua
A pesquisa no campo dos ADCs é extraordinariamente dinâmica e promissora. Novas gerações de ADCs estão em desenvolvimento, incorporando mecanismos de ação inovadores, como os que utilizam "dual payload" (dupla carga de agentes citotóxicos) ou agentes imunomoduladores. O objetivo é contínuo: expandir o espectro de tumores tratáveis, aprimorar a eficácia terapêutica e, crucialmente, reduzir ainda mais a toxicidade.
Além disso, a exploração de combinações de ADCs com imunoterapia, terapias-alvo e outras modalidades de tratamento está em ascensão. Essas abordagens combinadas visam potencializar os resultados, superando mecanismos de resistência e oferecendo novas esperanças para pacientes com cânceres de difícil tratamento. O futuro dos ADCs vislumbra uma oncologia ainda mais personalizada e eficaz.
Conclusão
Os anticorpos conjugados a drogas representam, sem dúvida, uma revolução na oncologia, concretizando a visão de uma terapia "bala mágica" que entrega quimioterapia de forma precisa e potente às células tumorais, com menor impacto no organismo global do paciente. Eles já são parte integrante do tratamento padrão para vários tipos de câncer, notavelmente o câncer de mama e uma lista crescente de outros tumores sólidos, com indicações estabelecidas ou em investigação em cenários de adjuvância, neoadjuvância e, predominantemente, em doenças avançadas ou metastáticas.
A vigilância contínua para o manejo dos efeitos colaterais e a incessante evolução tecnológica prometem tornar os ADCs ainda mais eficazes e seguros num futuro próximo, expandindo de forma significativa as possibilidades terapêuticas e a qualidade de vida para nossos pacientes oncológicos. Estamos testemunhando e participando ativamente de uma era dourada na terapia do câncer, onde a precisão define o caminho para um tratamento mais inteligente e humano.
Referências:
● [1] Protocolos Oncológicos de de tratamentos de mama. Dr Rafael Amaral de Castro.
● [2] Antibody-Drug Conjugates in Solid Tumor Oncology (pmc.ncbi.nlm.nih.gov/articles/PMC10459723/)
● [3] Antibody-Drug Conjugates: The New Treatment … (pmc.ncbi.nlm.nih.gov/articles/PMC11275051/)
● [7] Rise of Antibody-Drug Conjugates: The Present and Future (ascopubs.org/doi/10.1200/EDBK_390094)
● [9] Use of Antibody–Drug Conjugates in the Early Setting … (pmc.ncbi.nlm.nih.gov/articles/PMC11185006/)
● [10] Mechanisms of ADC Toxicity and Strategies to Increase … (pmc.ncbi.nlm.nih.gov/articles/PMC9913659/)
● [11] Dual-payload ADCs move into first oncology clinical trials (nature.com/articles/d41573-025-00121-y)
● [12] Antibody-drug conjugates in solid tumors; new strategy for … (pubmed.ncbi.nlm.nih.gov/38704241/)
● [13] The new ADC medicines represent a real revolution in … (fresenius.com/adc-medicines)
● [16] FDA Acts on 6 ADCs in Oncology: Rapid News Roundup (oncologynewscentral.com/drugs/info/fda-acts-on-adcs-in-oncology-rapid-news-roundup)
● [17] Antibody-drug conjugates for solid tumors (nature.com/collections/ffbceeadei)
● [19] Antibody drug conjugates (ADCs): an expanding rational … (binaytara.org/journal/article/33661-antibody-drug-conjugates-adcs-an-expanding-rational-treatment-paradigm-in-breast-cancer-cme-article)
● [20] Toxicity profile of antibody-drug conjugates in breast cancer (thelancet.com/journals/eclinm/article/PIIS2589-5370(23)00290-0/fulltext)
● [21] Targeting Cancers with Enhanced ADCs (beonemedicines.com/science/research-and-development/targeting-cancers-with-enhanced-adcs/)
Oncologia
Apoio e informações sobre tratamentos oncológicos.
Contato
Consultas
onconeoaccess@gmail.com
+55 61 981979192
61 993439998
61 34489255
© 2025. All rights reserved.